Miejsce chemii nieorganicznej w medycynie. Ten skromny kobalt…
A place of inorganic chemistry in medicine. This modest cobalt…
Urszula Śliwińska-Hill, Agnieszka Nieżyńska
Katedra i Zakład Chemii Analitycznej, Akademia Medyczna we Wrocławiu, ul. Szewska 38, 50-139 Wrocław
e-mail: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. (71) 784-03-08
Streszczenie
Choroby układu krążenia oraz nowotwory złośliwe stanowią główną przyczynę zgonów na świecie. Stosowane w terapii chorób nowotworowych leki charakteryzują się wysoką toksycznością, a wiele komórek wykazuje dużą oporność na podawane cytostatyki. Biomarkery wykorzystywane w diagnostyce zawału mięśnia sercowego pojawiają się we krwi z dużym opóźnieniem i dlatego też nie mogą stanowić źródła informacji o odwracalnym, przejściowym niedokrwieniu tego mięśnia. W związku z tym, iż nowo projektowane leki coraz częściej zawierają w swym składzie jon metalu, poniższa praca stanowi przegląd ostatnich badań skupionych na opracowaniu markerów niedokrwienia mięśnia sercowego oraz leków przeciwnowotworowych opartych na związkach kobaltu.
Słowa kluczowe: biomarkery w diagnostyce zawału mięśnia sercowego, test ACB, chemioterapia nowotworów, związki koordynacyjne kobaltu
Abstract
Cardiovascular diseases and malignant tumors are the leading cause of death worldwide. Drugs used in the treatment of cancers are highly toxic, and many of cancer cells show high resistance to administered cytotoxic drugs. Biomarkers used in the diagnosis of myocardial infarction appear too late in the blood, and therefore they can not be a source of information about reversible, transient ischemia of the miocardium. Due to the fact that the newly designed drugs contain a metal ion in their structure, the following paper is a review of recent research focused on the development of markers of myocardial ischemia and anticancer drugs, which are based on cobalt compounds.
Key words: biomarkers in the diagnosis of myocardial infarction, ACB test, chemotherapy, cobalt coordination compounds
Metale przejściowe mają coraz większe znaczenie w medycynie i farmacji XXI wieku. Preparaty farmaceutyczne zawierające w swym składzie jony metali stwarzają nowe możliwości w diagnostyce i terapii wielu schorzeń. Wyniki badań prowadzonych w ostatnich latach wskazują na wzrastającą rolę związków kobaltu w diagnostyce kardiologicznej oraz w chemioterapii nowotworów.
Kobalt został odkryty w Szwecji przez Georga Brandta w 1735 roku. Stanowi ok. 0.0025% skorupy ziemskiej [1]. Zaliczany jest do pierwiastków śladowych, niezbędnych dla organizmu, a jego zawartość w tkankach mieści się w granicach 0.005–0.5 ppm. W największych ilościach występuje w narządach miąższowych i mięśniach. Pierwiastek ten w organizmie występuje głównie pod postacią witaminy B12 pełniącej między innymi rolę regulatora produkcji erytrocytów oraz biorącej udział w metabolizmie białek i kwasów nukleinowych.
W medycynie kojarzony jest głównie z bombą kobaltową, czyli urządzeniem do naświetlania komórek nowotworowych promieniami gamma (γ) emitowanymi przez izotop kobaltu 60Co. Ważne miejsce zajmują również stopy kobaltu, które znajdują zastosowanie w stomatologii i ortopedii.
1. Rola związków kobaltu w najnowszej diagnostyce kardiologicznej
Choroby układu krążenia stanowią główną przyczynę przedwczesnej umieralności w społeczeństwach krajów uprzemysłowionych, w tym również w Polsce. Szacuje się, że mimo znacznych postępów w diagnostyce i leczeniu, choroby sercowo-naczyniowe pozostaną w większości krajów świata główną przyczyną zgonów co najmniej do 2020 roku [2].
Szczególnie istotne znaczenie ma diagnostyka chorych z zawałem mięśnia sercowego, ponieważ czas wdrożenia właściwej terapii ma kluczowe znaczenie w pozytywnych efektach leczenia oraz ograniczeniu niepożądanych powikłań [3]. Rozpoznanie kliniczne ostrych zespołów wieńcowych (OZW) opiera się na wyniku badania EKG oraz oznaczaniu markerów uszkodzenia mięśnia sercowego, takich jak troponina I (cTnI), troponina T (cTnT), izoenzym kinazy kreatynowej (CK-MB) oraz mioglobina (Myo). Wszystkie wymienione biomarkery pojawiają się we krwi stosunkowo późno, a ich źródło stanowią obumarłe komórki miocardium, a zatem markery te nie mogą być stosowane w diagnostyce odwracalnego uszkodzenia mięśnia sercowego poprzedzającego proces martwicy [4]. Z tego powodu poszukuje się nowych wskaźników informujących o niedokrwieniu mięśnia sercowego we wczesnej jego fazie, przebiegającego bez martwicy miocardium. Rolę biomarkera spełniającego te warunki może pełnić albumina modyfikowana niedokrwieniem (IMA - Ischemia Modified Albumin) (Rysunek 1) [5].

Rysunek 1. Dynamika zmian stężenia IMA w odniesieniu do innych markerów niedokrwienia mięśnia sercowego [6]
Albumina (HSA - Human Serum Albumin) jest głównym białkiem osocza krwi. Pełni w organizmie wiele rożnych funkcji, m.in. utrzymuje prawidłowe ciśnienie osmotyczne krwi, ma wpływ na przepuszczalność ścian naczyń włosowatych, jest magazynem aminokwasów, działa przeciwzakrzepowo, a także posiada właściwości buforujące oraz antyoksydacyjne. Jednak jedną z najważniejszych funkcji albuminy jest zdolność wiązania i transportowania wielu egzo- i endogennych substancji takich jak hormony, bilirubina, kwasy tłuszczowe, porfiryny, leki oraz jony metali [7-9]. Wśród tych ostatnich znajdują się występujące w organizmie w warunkach prawidłowych jony Ca2+, Cu2+, Zn2+, Co2+, toksyczne jony Cd2+ i Ni2+ oraz dostarczane w postaci środków farmakologicznych związki Au+ i Pt2+. Różnorodność przyłączanych metali wynika z obecności w cząsteczce albuminy czterech miejsc, do których poszczególne kationy wykazują powinowactwo [10]. Są to: N-koniec, Cys34 oraz tzw. miejsce A i miejsce B. Ta właściwość albuminy stała się punktem wyjścia przy poszukiwaniu nowych markerów niedokrwienia mięśnia sercowego. Ma to związek z założeniem, że niedokrwienie powoduje zmiany konformacyjne w cząsteczce albuminy zmniejszające jej zdolność do wiązania i transportowania jonów Co2+. Czynniki wywołujące te zmiany mają związek z następującym po niedokrwieniu stresie oksydacyjnym, reperfuzją, kwasicą, zmniejszoną prężnością tlenu oraz zaburzeniami w funkcjonowaniu pompy sodowej i wapniowej, a zmienione w ich wyniku cząsteczki albuminy to albumina modyfikowana niedokrwieniem IMA [4,5]. W celu oceny stopnia tej formy modyfikacji albuminy stosuje się test pozwalający na jej oznaczanie. Nosi on nazwę Albumin Cobalt Binding Test – ACB i polega na ocenie intensywności reakcji barwnej ditiotreitolu (DTT) z egzogennym kobaltem dodanym w nadmiarze w postaci chlorku kobaltu (CoCl2). Produktem tej reakcji jest kompleks DTT z jonami kobaltu niezwiązanymi przez białko. Im wyższe stężenie IMA tym mniejsza ilość Co2+ jest wiązana i tym intensywniejsze nasilenie barwnej reakcji niezwiązanego kobaltu z DTT. Jest to zależność wprost proporcjonalna. Pomiar dokonywany jest spektrofotometrycznie przy długości fali λ=470 nm. Wynik podaje się w tzw. jednostkach wiązania kobaltu przez albuminę osocza – ABSU (z ang. Albumin Binding Serum Units). Wartości referencyjne oznaczenia wahają się w granicach 0,316 ± 0,092 do 0,43 ± 0,10 ABSU.
Dostępny jest także test komercyjny produkowany przez firmę Ischemia Technologies z Denver w Stanach Zjednoczonych ( Test ACB ®) dopuszczony do użytku w 2003 roku przez amerykańską Agencję ds. Żywności i Leków FDA. Umożliwia szybki pomiar stężenia wyrażanego w jednostkach U/ml lub KU/l. Za wartości prawidłowe przyjmuje się przedział 52,76 – 116,56 U/ml.
Warunkami otrzymania wiarygodnego wyniku są:
- wykonanie oznaczenia w ciągu 2,5 godziny lub zamrożenie próbki w temp. -20oC
- nie rozcieńczanie próbek
- próbka nie może być zhemolizowana [6,7,11].
Wraz z opracowaniem testu ACB wzrosło zainteresowanie wiązaniem przez HSA jonów Co2+. Miejsce ich wiązania jest jednak sporne. Obecnie spośród czterech miejsc wiązania jonów metali (miejsce A i B, N-koniec cząsteczki i Cys34) wykluczono jedynie Cys34. Do niedawna za główne miejsce wiązania Co(II) przyjmowano N-końcowy fragment łańcucha albuminy [4]. Wyniki najnowszych badań wykazują, że jony kobaltu (II) mogą wiązać się w trzech miejscach wiązania metali. Dwa pierwsze jony wiążą się w miejscu A lub B, a trzeci jon zostaje związany na N-końcu cząsteczki albuminy [10,12]. W związku z tym sugeruje się, że test ACB mierzy w pierwszej kolejności różnicę w poziomie wiązania kobaltu w miejscu A lub B, a nie na N-końcu HSA jak początkowo sądzono. Ma to istotne znaczenie, ponieważ dowodzi, że modyfikacje albuminy spowodowane niedokrwieniem zachodzą w obrębie obszarów miejsca A i B znajdujących się wewnątrz cząsteczki. Na podstawie przeprowadzonych badań [12] można wywnioskować, że istnieje konkurencja pomiędzy wiązaniem jonów Co2+ a kwasami tłuszczowymi, których wysoka zawartość w surowicy pacjenta może powodować obniżenie stopnia wiązania Co(II) do miejsca A i tym samym zwiększać ilość niezwiązanej albuminy w teście ACB.
Wśród innych czynników wpływających na wiązanie jonów kobaltu w cząsteczce albuminy istotne znaczenie mają:
- stężenie HSA w osoczu oraz ilość nieuszkodzonego fragmentu N-końcowego w HSA
- pH osocza krwi
- obecność jonów Cu(II) oraz Cd(II)
- oddziaływanie DTT z kompleksem Co-HSA [13].
Możliwość wykorzystania testu w diagnostyce niedokrwienia mięśnia sercowego budzi w ostatnich latach pewne wątpliwości. Początkowo pomiar IMA był rozważany w kontekście diagnostyki ostrych zespołów wieńcowych ze względu na to, że marker ten pojawia się we krwi dużo wcześniej niż standardowo stosowane wskaźniki, bo już po 15 minutach [7]. W miarę rozwoju badań nad IMA zmieniał się stosunek do jej wykorzystania w diagnostyce, głównie z powodu małej swoistości. Obecnie oznaczanie IMA zalecane jest jako badanie dodatkowe, służące do celów prognostycznych zagrażającego niedokrwienia, a nie jako test potwierdzający OZW [11], gdyż różnicuje osoby zdrowe od tych z niedokrwieniem, ale nie różnicuje pacjentów z niedokrwieniem, u których nie doszło do zawału mięśnia sercowego od pacjentów ze zdiagnozowanym zawałem [7].
Badania dotyczące IMA wykazują, że ta modyfikacja jest nie tylko wskaźnikiem niedokrwienia, ale również wykładnikiem jego rozległości [5,7], a jej oznaczanie może służyć jako kontrola skuteczności udrożnienia tętnicy wieńcowej [11]. Albumina modyfikowana niedokrwieniem może być wykorzystana w roli markera blaszek miażdżycowych [14], a także stresu oksydacyjnego w różnych stanach klinicznych np. przewlekłej niewydolności nerek, hipercholesterolemii, cukrzycy typu drugiego [15]. Od roku 2000, kiedy opisano po raz pierwszy możliwość zastosowania IMA w diagnostyce niedokrwienia mięśnia sercowego [16] można zaobserwować, że wraz z postępem prac badawczych swoistość testu zmniejsza się. Jest to spowodowane wpływem na wynik badania innych stanów chorobowych, które współistnieją z przemijającym lub długotrwałym niedotlenieniem tkanek, nie tylko w obrębie miocardium [7]. Ponadto trudności z interpretacją wyników oznaczenia IMA mogą przysporzyć badania chorych z marskością wątroby, infekcjami, chorobami nowotworowymi, niewydolnością nerek, a także po udarze mózgu [5].
Niemniej jednak test wiązania kobaltu przez albuminę modyfikowaną niedokrwieniem uważa się za obiecującą metodę różnicowania bólów w klatce piersiowej w warunkach szpitalnej izby przyjęć.
2. Rola związków kobaltu we współczesnej terapii przeciwnowotworowej
W ostatnim dziesięcioleciu nastąpił ogromny postęp w onkologii, lecz wciąż nierozwiązany pozostaje problem toksyczności i selektywności działania stosowanych cytostatyków. Nie bez znaczenia jest również fakt, że wiele komórek nowotworowych wykazuje dużą oporność na stosowane terapie. W związku z tym prowadzone są badania oparte na poszukiwaniu rozwiązań, które zapewnią selektywne dostarczenie leku do komórki nowotworowej, zminimalizują systemową toksyczność terapii i ominą barierę oporności komórek na aplikowane leki. Jednym z rozwiązań wspomnianych problemów jest wiązanie wykorzystywanych w praktyce klinicznej związków z atomem metalu jako nośnikiem leku do komórki nowotworowej lub w celu modyfikacji jego właściwości.
Historia chemioterapii sięga 1942 roku, kiedy to w porcie w Bari we Włoszech, podczas niemieckiego nalotu doszło do wybuchu amerykańskiego statku transportującego iperyt. U wielu poszkodowanych marynarzy zaobserwowano wtedy pancytopenię, czyli zaburzenie hematologiczne polegające na niedoborze wszystkich prawidłowych elementów morfotycznych krwi: erytrocytów, leukocytów i trombocytów. Wydarzenie to dało początek badaniom nad zastosowaniem pochodnych iperytu w leczeniu nowotworów [17].
Iperyty azotowe (Rysunek 2) są związkami organicznymi należącymi do grupy chlorowcopochodnych amin alifatycznych. Iperyt azotowy wykazuje dużą zdolność niszczenia komórek i stanowi związek macierzysty dla całej grupy cytostatyków o właściwościach alkilujących. Do najważniejszych pochodnych iperytu azotowego należą cyklofosfamid, ifosfamid, chlorambucyl, melfalan stosowane szeroko w chemioterapii wielu nowotworów. Związki te tworzą wiązania z DNA, uniemożliwiając jego replikację i podział komórek. Głównym miejscem wiązania tej grupy cytostatyków jest przede wszystkim silnie nukleofilowy atom N-7 guaniny [17], jednak nie można wykluczyć również atomów N-1 i N-3 adeniny oraz N-3 cytozyny.

Rysunek 2. a) iperyt, b) iperyt azotowy
W celu zmniejszenia toksyczności iperytu azotowego połączono go w kompleks ze związkiem kobaltu (III), zapewniający obojętny transport tej cytotoksycznej cząsteczki do komórek nowotworowych (Rysunek 3) [17]. W komórce zachodzi redukcja kinetycznie stabilnego, obojętnego centrum metalicznego do bardziej labilnego Co(II) i następuje osłabienie wiązania Co-N, co skutkuje uwolnieniem reaktywnego iperytu, który powoduje szereg reakcji podwójnej alkilacji DNA [18]. Ważnym elementem struktury omawianego kompleksu są ligandy metyloacetyloacetonianowe (Meacac), które zapewniają optymalne wartości potencjału redukcyjno-oksydacyjnego kontrolującego selektywność wobec komórek hipoksemicznych. Otrzymany związek zapewnia lepszą selektywność, korzystny profil toksykologiczny oraz możliwość transportu na drodze dyfuzji biernej do wnętrza komórki. W komórkach nowotworowych zredukowane aniony kompleksu Co(II) zostają uwięzione i zachodzi powolne uwolnienie cytotoksycznych cząsteczek iperytu azotowego.
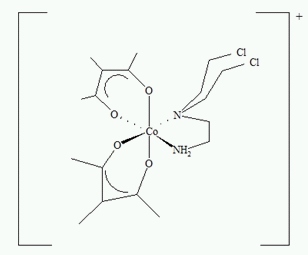
Rysunek 3. Struktura kompleksu Co(III) z iperytem azotowym [19].
Innowacyjnym podejściem do terapii chorób nowotworowych jest zastosowanie selektywnych inhibitorów enzymów odpowiedzialnych za procesy metastazy. Wykorzystywana jest aktywność specyficznych matryc metaloproteinazowych (MMP), powodujących rozpad tkanki łącznej, a w szczególności wybiórcze rozdzielanie białek matryc na mniejsze fragmenty. Aktywacja MMP jest ściśle regulowana w komórkach zdrowych, natomiast ich nadekspresję zaobserwowano w inwazyjnych komórkach nowotworowych. Nadekspresja MMP-2 i MMP-9 jest skorelowana ze stopniem agresywności nowotworu - wzrost aktywności MMP-9 występuje jednocześnie z podwyższonym potencjałem tworzenia przerzutów. Na tej podstawie opracowano wiele inhibitorów MMP, m. in. batimastat i marimastat, (Rysunek 4a, 4b), które zostały dopuszczone do badań klinicznych. Jak wykazywały wstępne badania marimastat miał znaczną aktywność cytostatyczną, jednak III faza badań klinicznych nie wykazała znaczących różnic w efektach działania marimastatu w porównaniu do stosowanych obecnie terapeutykow. Prawdopodobną przyczyną tego stanu jest inaktywacja inhibitora MMP poprzez kompleksowanie z metalami przejściowymi. Obserwacja ta stała się podstawą utworzenia przenośnika marimastatu w postaci kompleksu kobaltu, dzięki czemu marimastat zostaje przeniesiony w nieaktywnej formie do docelowego miejsca działania. Inaktywacja zostaje osiągnięta po związaniu go w kompleks z Co(III) i tris(metylopirydylo)aminą (tpa) jako drugim ligandem (Rysunek 4c). Układ Co(III)-tpa stanowi niezbędny szkielet strukturalny i elektrochemiczny, dzięki któremu cząsteczka marimastatu jest docelowo kierowana do komórek rakowych. Jego niski potencjał redukcyjny pozwala na pozostanie związku w stanie podstawowym do chwili dotarcia do hipoksemicznego środowiska komórek nowotworowych. Selektywna aktywacja zachodzi w komórce nowotworowej, w której następuje redukcja Co(III) do bardziej labilnego Co(II) i jednoczesne uwolnienie cząsteczki marimastatu. W przeprowadzonych badaniach kompleks Co(III) - marimastat wykazuje wyższy stopień inhibicji wzrostu nowotworu niż marimastat bez układu przenośników [20].

Rysunek 4. a) batimastat, b) marimastat, c) kompleks Co(III) z marimastatem - [Co(mmst)tpa]ClO4] [20].
Podsumowanie
Dotychczasowe wyniki badań wykorzystujących związki kobaltu w diagnostyce chorób serca oraz w chemioterapii nowotworów pozostawiają wiele kwestii otwartych. Wciąż prowadzone eksperymenty ukazują nowe potencjalne możliwości zastosowania jonów kobaltu, a ich rezultaty mogą okazać się przełomowe dla rozwoju nowoczesnej kardiologii i onkologii.
Literatura
[1] A. Bielański, Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa, 1997, 33, 900-928.
[2] Atlas of Heart Disease and Stroke, WHO, 2004 Sept.
[3] W. Kostowski, Z.S. Herman: Farmakologia-podstawy farmakoterapii. PZWL, Warszawa 2008, II, s. 232-241, s. 556-557.
[4] L. Trynda-Lemiesz, K. Wiglusz, I. Mucha: Rola albuminy w diagnostyce. Wiązanie jonów i kompleksów metali. Wiadomości chemiczne, vol. 64, 2010, s. 1-2.
[5] W. Myszka, J. Dudziak, L. Torliński: Albumina modyfikowana niedokrwieniem – nowy marker biochemiczny. Nowiny Lekarskie, vol.75, 2, 2006, s. 174-178.
[6] W. Piechota, W. Piechota: Albumina zmodyfikowana niedokrwieniem-nowy biochemiczny marker niedokrwienia mięśnia serca. LabForum, vol. 12, 2005, s. 4-8.
[7] M. Knapik-Kordecka, A. Piwowar, E. Żurawska-Płaksej, M. Warwas: Albumina modyfikowana niedokrwieniem – specyficzny marker w diagnostyce kardiologicznej? Wiadomości lekarskie, vol. 10-12, 61, 2008, s. 263-268.
[8] J. Gburek, K. Gołąb, K. Juszczyńska: Nerkowy katabolizm albuminy – aktualne poglądy i kontrowersje. Postępy Higieny i Medycyny Doświadczalnej, vol. 65, 2011, s. 668-677.
[9] U. Kragh-Hansen, V.T.G. Chuang, M. Otagiri: Practical Aspects of the Ligand-Binding and Enzymatic Properties of Human Serum Albumin. Biological & Pharmaceutical Bulletin, vol. 25, 6, 2002, s. 695-704.
[10] M. Sokołowska, M. Wszelaka-Rylik, J. Poznański, W. Bal: Spestroscopic and thermodynamic determination of three distinct binding sites for Co(II) ions in human serum albumin. Journal of Inorganic Biochemistry, vol. 103, 2009, s. 1005-1013.
[11] J.W. Naskalski: Oksydatywnie zmodyfikowana albumina (IMA) jako wskaźnik niedotlenienia mięśnia sercowego. Przegląd medycyny laboratoryjnej, vol.5, 1, 2006, s. 18-23.
[12] E. Mothes, P. Faller: Evidence that the Principal CoII-Binding Site in Human Serum Albumin Is Not at the N-Terminus: Implication on the Albumin Cobalt Binding Test for Detecting Myocardial Ischemia. Biochemistry, vol. 46, 2007, s. 2267-2274.
[13] D. Bar-Or, L.T. Rael, R. Bar-Or, D.S. Slone, C.W. Mains, N.K.R. Rao, C.G. Curtis: The cobalt-albumin binding assay: Insights into its mode of action. Clinica Chimica Acta, vol. 387, 2008, s. 120-127.
[14] M.M.M.F. Duarte, J.B.T. Rocha, R.N. Moresco, T. Duarte, I.B.M Da Cruz, V.L. Loro, M.R.C Schetinger: Association between ischemia-modified albumin, lipids and inflammation biomarkers in patients with hypercholesterolemia. Clinical Biochemistry, vol. 42, 2009, s. 666-671.
[15] M. Kaefer, S.J. Piva, J.A.M. De Carvalho, D.B. Da Silva, A.M. Becker, A.C. Coelho, M.M.M.F Duarte, R.N Moresco: Association between ischemia modified albumin, inflammation and hyperglycemia in type 2 diabetes mellitus. Clinical Biochemistry, vol. 43, 2010, s. 450-454.
[16] D. Bar-Or, E. Lau, J.V. Winkler: A novel assay for cobalt-albumin binding and its potential as a marker for myocardial ischemia –a preliminary report. The Journal of Emergency Medicine, vol. 19, 4, 2000, s. 311-315.
[17] E. Mutschler, G. Geisslinger, H. K. Kroemer, P. Ruth, M. Schafer-Korting, Farmakologia i toksykologia, II polskie poprawione i uzupełnione, W. Buczko, MedPharm Polska, Wrocław, 2010.
[18] D. C. Ware, P. J. Brothers, G. R. Clark, W. A. Denny, B. D. Palmer, W. R. Wilson, Synthesis, structures and hypoxia-selective cytotoxicity of cobalt(III) complexes containing tridentate amine and nitrogen mustard ligands, J. Chem. Soc., Dalton Trans., 2000, s. 925-932.
[19] E. Reisner, V. B. Arion, B. K. Keppler, A. J. L. Pombeiro, Electron-transfer activated metal-based anticancer drugs, Inorg. Chim. Acta, vol. 361, 2008, s. 1569–1583.
[20] T. W. Failes, C. Cullinane, C. I. Diakos, N. Yamamoto, J. G. Lyons, T. W. Hambley, Studies of a Cobalt(III) Complex of the MMP Inhibitor Marimastat: A Potential Hypoxia-Activated Prodrug, Chem. Eur. J., vol. 13, 2007, s. 2974-2982.






Komentarze obsługiwane przez CComment