 PARACETAMOL WILK w OWCZEJ SKÓRZE?
PARACETAMOL WILK w OWCZEJ SKÓRZE?
Paracetamol - a wolf in sheep's clothing?
Przemysław Skibiński
"Stale rosnąca popularność i obecność paracetamolu jako składnika preparatów przeciwbólowych czy przeciwgorączkowych powoduje, że istotne stają się skutki uboczne związane nie tylko z jego przedawkowaniem ale także ze stałym stosowaniem paracetamolu w dawkach określonych jako.."
Paracetamol – wilk w owczej skórze?
Paracetamol - a wolf in sheep's clothing?
Przemysław Skibiński
Katedra i Zakład Chemii Analitycznej Akademii Medycznej we Wrocławiu
ul. Szewska 38, 50-139 Wrocław
Abstrakt: Stale rosnąca popularność i obecność paracetamolu jako składnika preparatów przeciwbólowych czy przeciwgorączkowych powoduje, że istotne stają się skutki uboczne związane nie tylko z jego przedawkowaniem ale także ze stałym stosowaniem paracetamolu w dawkach określonych jako bezpieczne.
Słowa kluczowe: paracetamol, hepatotoksyczność, uszkodzenie wątroby, acetaminofen, N-acetylo-p-benzochinoimina
Abstract: Constantly growing popularity and presence of paracetamol which is a component of painkillers and antipyretics causes, that significant adverse effects become related not only to overdose of paracetamol, but also of a continued application of the dosages that are specified as secure.
Keywords: Paracetamol; Acetaminophen; Hepatotoxicity; Liver failure; N-acethyl-p-benzo-quinonoimine
Historia paracetamolu sięga lat 80-tych XIX wieku, kiedy odkryto przeciwgorączkowe działanie aniliny. W związku z jej dużą toksycznością i niemożnością użycia jej jako leku, zsyntetyzowano jej N-acetylową pochodną – acetanilid, znany pod nazwą antyfebryna, która ze względu na nadal duża toksyczność została zastąpiona przez kolejną pochodną – p-etoksyacetanilid, znaną jako fenacetyna. Stosunkowo długi okres w jakim była ona stosowana (wycofana w USA w 1983 roku) pozwolił na jej dokładne zbadanie i opisanie wszystkich poważnych działań niepożądanych. Najważniejsze, czyli methemoglobinemia, powodująca hemolizę krwinek i sinicę ale także właściwości rakotwórcze i uszkadzające nerki związane były z biotransformacją fenacetyny i powstającym w tym procesie 4-etoksy-nitrobenzenem [1,2].
Przy okazji wspomnianych badań odkryto jeden z pozostałych produktów biotransformacji fenacetyny, związek powstały przez jej dealkilację – N-acetylo-p-aminofenol, znany pod nazwą paracetamol. Stało się to w roku 1893. Jednakże, dopiero w 1949 roku potwierdzono, że związek ten odpowiada za efekt przeciwbólowy.
Paracetamol wprowadzono na rynek leków po raz pierwszy w latach 50-tych XX wieku w USA. W Polsce nastąpiło to w latach 90. Funkcjonował on jako alternatywa dla aspiryny w przypadku przeciwskazań do jej stosowania [1,3].
Od lat 80. XX wieku jest niemal najczęściej stosowaną substancją na świecie w leczeniu dolegliwości bólowych oraz gorączki u dorosłych i dzieci. Jest on wyróżniany obok grupy niesteroidowych leków przeciwzapalnych (NLPZ), jednak nie wykazuje działania przeciwzapalnego, a jedynie przeciwbólowe i przeciwgorączkowe.
Wielostronne działanie paracetamolu może zostać w znacznym stopniu poszerzone przez stosowanie w połączeniu z substancjami wykazującymi samodzielne działanie na objawy towarzyszące stanom chorobowym. Wykorzystuje się także działania synergistyczne.
Do głównych i najczęściej stosowanych związków leczniczych stosowanych w połączenia z paracetamolem należą: difenhydramina, feniramina, chlorfenamina, fenylefryna, ibuprofen, kodeina, dekstrometorfan, kofeina, kwas askorbinowy, pseudoefedryna, tramadol i wodzian terpinu.
Paracetamol w sprzedaży
Od momentu wprowadzenia na rynek, w Polsce zarejestrowano ok. 700 preparatów [4] zawierających w swym składzie paracetamol (liczba ta uwzględnia także różne dawki i wielkości opakowań). Część preparatów (np. połączenia z tramadolem) wymaga przepisania na receptę, jednak zdecydowana większość z nich należy do leków z tzw. grupy OTC (Over The Counter), czyli dostępnych bez recepty. Dodatkowo, równoczesne wprowadzenie tych preparatów do sprzedaży poza aptecznej (kioski, hipermarkety, sprzedaż przez Internet itp.), zdecydowanie utrudnia kontrolę nad obrotem i zwiększa ryzyko związane z ich zażywaniem tym bardziej, że traktowane są one w tych miejscach jako produkt powszedni do codziennego stosowania.
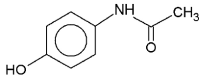
Rysunek 1. Paracetamol inaczej Acetaminophen, łac. Paracetamolum, nazwa systematyczna: N( 4hydroksyfenylo) acetamid
Do pełnego obrazu dodać należy informację, że w statystyce wydatków na leki z wspomnianej grupy Polska zajmuje 5 miejsce w Europie. Stopniowo wzrasta także zjawisko samoleczenia, przy wykorzystaniu np. porad przekazywanych na forach internetowych. Wyniki badań obejmujące lata 2006 – 2010 wskazują na systematyczny wzrost sprzedaży leków OTC, wynoszący ok. 10% rocznie. Dane dotyczące tego samego okresu pokazują, że niewielka część pacjentów wykazuje zainteresowanie informacjami zamieszczonymi w ulotkach, uznając leki OTC za w pełni bezpieczne i pozbawione działań niepożądanych. W przekonaniu tym utwierdza też fakt, że leki te można kupić właśnie poza kontrolą apteki. Na podjęcie decyzji o zakupie leku niewielki wpływ ma rodzaj substancji czynnej, ale w szczególności nazwa handlowa preparatu, szata graficzna opakowania, cena oraz reklama w środkach masowego przekazu [5, 6].
Równocześnie badania wykazują, że jedynie 21% osób w wieku poniżej 60 r.ż. z lekkimi objawami chorobowymi (np. infekcje górnych dróg oddechowych) zgłasza się do lekarza, natomiast w grupie powyżej 60 r.ż. odsetek ten wynosi już 70%. Wśród osób nie korzystających z porady w gabinecie lekarskim, tylko 30% chorych konsultuje się z farmaceutą przed zakupem leku z grupy OTC [5].
Działanie paracetamolu
Mechanizm działania paracetamolu jest wciąż niejasny, mimo iż od ponad pół wieku jest stosowany w lecznictwie. Wiadomo, że za jego działanie odpowiadają co najmniej dwa szlaki. Jeden z nich opiera się na wybiórczym hamowaniu cyklooksygenazy- COX-3, która jest odmianą COX-1. Ponadto nie blokuje w sposób istotny syntezy prostaglandyn na obwodzie (w tym też w miejscu zapalenia), przez co nie wykazuje efektów ubocznych, charakterystycznych dla typowych NLPZ, jak np. owrzodzenia przewodu pokarmowego. Mechanizm działania przeciwgorączkowego polega (poza blokowaniem prostaglandyn w podwzgórzu) na wpływie na ośrodek termoregulacji a także na rozszerzaniu skórnych naczyń krwionośnych i zwiększaniu wydzielania potu ułatwiając tym samym oddanie ciepła. W latach 90. XX wieku odkryto, że paracetamol pobudza rdzeniowe, zstępujące szlaki serotoninergiczne, które biorą udział w tłumieniu przewodzenia bodźców bólowych [2, 3].
Najnowsza teoria dotycząca jednego z mechanizmów działania przeciwbólowego paracetamolu związana jest z układem endokanabinoidowym, odpowiedzialnym za działanie kanabinoidów. Wiąże się to z aktywacją receptorów dla kanabinoidów (CB1) oraz receptorów waniloidowych (TRPV1) w strukturach nerwowych odpowiedzialnych za przewodzenie i odczuwanie bólu oraz termoregulację. Wiadomo, że przeciwbólowemu działaniu paracetamolu czasem towarzyszy specyficzne polepszenie samopoczucia, rozluźnienie psychiczne i uspokojenie - objawy na pewno słabsze, ale podobne do tych, które występują po zażyciu egzogennych kanabinoidów (np. marihuana). Opierając się na doświadczeniach na szczurach dostrzeżono, że blokada receptora CB1 jego antagonistą znosi działanie przeciwbólowe paracetamolu [2,7].
Związane być może z tym mechanizmem działania jest także spostrzeżenie, iż nagłe odstawienie leku, po długotrwałym stosowaniu w dużych dawkach, może być przyczyną osłabienia, bólów głowy, bólów mięśniowych, objawów wegetatywnych i niepokoju [8]. Okres półtrwania paracetamolu wynosi ok. 2 – 3 godzin a jest metabolizowany głównie w wątrobie dwoma szlakami: poprzez sprzęganie z kwasem glukuronowym (60%) i siarkowym (35%). Około 5% wydalane jest z moczem w postaci niezmienionej [8]. Dodatkowym szlakiem jest utlenianie katalizowane wątrobowym cytochromem P-450 i jego izoenzymami CYP2E1 (obecnym także w nerkach), CYP3A4 i CYP1A2 [9]. Istotną informacją są induktory powyższych izoenzymów, które zwiększają ich aktywność.. Wymieniając najważniejsze dla pierwszego z nich są to etanol i izoniazyd, dla drugiego – głównie leki przeciwpadaczkowe (karbamazepina i fenytoina) oraz barbiturany, dla ostatniego natomiast – omeprazol i składniki dymu tytoniowego [9].
Mikrosomalna oksydacja, indukowana cytochromem P-450 zaczyna mieć znaczenie w wyniku przyjęcia większych dawek lub też w wyniku zmniejszonej zdolności wątroby do łączenia z kwasami glukuronowym czy siarkowym. Niezmiernie istotne jest także działanie induktorów, szczególnie tych dla izoenzymu CYP2E1. Czynniki te powodują powstawanie toksycznych metabolitów, głównie N-acetylo-p-benzochinoiminy (NAPQI). W prawidłowych warunkach ulega on szybkiej detoksykacji, dzięki połączeniu z grupami sulfhydrylowymi glutationu, (będącego naturalnym antyoksydantem organizmu), i późniejszym wydaleniu z moczem, po sprzęgnięciu z cysteiną i kwasem merkaptopurynowym [10].
Jednak nadmierne nagromadzenie NAPQI powoduje jego łączenie się z białkami hepatocytów powodując martwicę komórek wątroby. W nieco mniejszym stopniu dotyczy to także nerek. Przy powstającym NAPQI również osoby z niedoborem dehydrogenazy glukozo-6-fosforanowej narażone są na pojawienie się gwałtownych objawów niedokrwistości hemolitycznej. Szybkie podanie donorów grup SH, jak metioniny czy acetylocysteiny pozwala ograniczyć działanie tak toksycznego utleniacza, jakim jest NAPQI [8].
Ważną ciekawostką może być fakt, że w związku z brakiem transferazy s-glutationowej i tym samym brakiem możliwości sprzęgania szkodliwego metabolitu paracetamolu z glutationem, związek ten jest wysoce toksyczny dla kotów, już w dawce 10mg/kg m.c. [11, 12].
Działania niepożądane paracetamolu
Maksymalna doustna dawka paracetamolu jest określana na 1 – 1,5 g, dobowa – 4 g. W przypadku zdrowego człowieka zażycie jednorazowej dawki 10 g, u dzieci natomiast 150mg/kg mc., w przypadku nie zastosowania natychmiastowego leczenia, może doprowadzić do zgonu w przeciągu 48 godzin. Wartości te ulegają znacznemu zmniejszeniu przede wszystkim w przypadku osób nadużywających alkoholu (dawka dobowa 2 g,ale także z niewydolnością wątroby i nerek [8, 13].
Na szczególną uwagę w Polsce zasługuje zespół alkoholowo – paracetamolowy, charakteryzujący się ostrą niewydolnością wątroby, kojarzoną z reguły tylko z toksycznym działaniem alkoholu. Po uwzględnieniu jednak nadmiernego spożycia zarówno alkoholu jak i paracetamolu, możliwym jest fakt, że nałożenie się hepatotoksyczności obu związków może być wyjątkowo groźnym połączeniem [14].
Odnotowano przypadki niespodziewanej hepatotoksyczności u ludzi zażywających leki przeciwpadaczkowe [8].
Należy zwrócić także uwagę na fakt genetycznej zmienności, dotyczącej zdolności do reakcji sprzęgania paracetamolu z kwasami glukuronowym i siarkowym [9]. Problem ten dotyczy także genetycznej zmiennej wydajności izoenzymów cytochromu P-450, mogących produkować nadmierne ilości NAPQI.
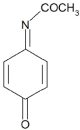
Rysunek 2. Nacetylopbenzochinoimina (NAPQI)
Dodatkowo stwierdzono, opierając się na badaniach na królikach, że paracetamol zażywany przez dłuższy okres (do 62 dni) w dawkach 50mg/kg mc. nie powodował zmian w wątrobie możliwych do zaobserwowania przy pomocy standardowych testów (poziomy aminotransferaz AST i ALT) wykorzystywanych do rutynowego określania stopnia uszkodzenia wątroby. Dyskretne zmiany w metabolizmie wątrobowym ujawnione zostały dopiero po przeprowadzeniu oznaczenia stężenia ciał ketonowych (AKBR) [15].
Podobne, ujawniające się wolno zmiany następujące pod wpływem paracetamolu, mogą dotyczyć struktury kości i tym samym ryzyka złamania u kobiet w okresie po menopauzalnym [16].
Paracetamol uznawany jest za lek bezpieczny zarówno dla kobiet w ciąży jak i noworodków czy dzieci, co poświadcza przyznana kategoria B wg. FDA (Food and Drug Administration) i kategoria A wg. ADEC (Australian Drug Evaluation Committee) [17]. Niepokoić zatem może fakt pojawiania się doniesień o możliwym powiązaniu między ekspozycją na paracetamol w okresie prenatalnym, między 20 a 30 tygodniem ciąży, a późniejszych epizodach astmatycznych i uczuleniowych u tych dzieci w wieku przedszkolnym. [18, 19, 20].
Badania na ciężarnych szczurzycach wykazały także pojawienie się u zarodków antyandrogennego działania, w przypadku zastosowania dawki większej od 3 do 7 razy w porównaniu do dawki zalecanej u ludzi [21].
Stała i nieograniczona obecność paracetamolu jako swoistego „suplementu diety” zaczyna być widoczna chociażby w statystykach samobójstw. Dane z 2007 r. dotyczące USA, wspominają o 56 tyś. przypadkach lekarskich interwencji domowych, 26 tyś. hospitalizacji i 450 przypadkach śmiertelnych związanych z przedawkowaniem paracetamolu [22].
W Irlandii według danych z 2004 roku, na ok. 8000 przypadków prób samobójczych przy użyciu leków, w ponad 30% zażyto paracetamol, zakupiony głównie w kioskach [23]. Dodać należy, że w Irlandii prawo zabrania sprzedaży w aptece więcej niż 12 gramów paracetamolu podczas jednej transakcji [24]. Podobne ograniczenia zostały wprowadzone w Wielkiej Brytanii, po których stwierdzono zauważalnie mniejszą liczbę przypadków przedawkowania tego leku jak i powiązaną z tym liczbę przeszczepów wątroby [25, 26]. Dodać jednak należy, że liczba zarejestrowanych preparatów o odmiennych nazwach, szatach graficznych, osobnych wskazaniach (ból zatoki, ból głowy, przeziębienie, bóle menstruacyjne) prowadzić mogą także do nieświadomego przedawkowania, szczególnie w okresie np. zwiększonych infekcji grypowych czy przeziębień.
Podsumowanie
Bardzo duże rozpowszechnienie paracetamolu, częstość jego stosowania, na zażywanie go w bardzo szerokim przedziale wiekowym i w coraz większych dawkach powodują, że ujawniają się z istotną statystycznie częstością oraz nowe działania niepożądane. Dodatkowo, w tych warunkach mamy także do czynienia z dużą ilością interakcji z innymi stosowanymi lekami. Pierwszym krokiem pozwalającym ograniczyć ten niekorzystny proces powinno być dokładne i wyraźne oznaczenie na pudełkach preparatów leczniczych, informujące o obecnym w ich składzie paracetamolu. Kumulujące się powoli patologiczne skutki nadużywania tej substancji mogą ujawnić się w znaczącym stopniu już za kilka lat. Miejmy nadzieję, że wcześniej uda się zahamować ten proces.
Literatura
[1] Zejc A., Gorczyca M.: Chemia leków podręcznik dla studentów farmacji i farmaceutów, Wyd. PZWL, Warszawa, 2008, s. 175 – 177.
[2] Korbut R.: Farmakologia tajemnice podręcznik dla studentów kierunków medycznych. Wyd. Uniwersytetu Jagiellońskiego, Kraków, 2009, s. 59-60.
[3] Mutschler E., Geisslinger G., Kroemer H. K., Ruth P., Schafer-Korting M.: Farmakologia i toksykologia, Wyd. MedPharm Polska, Wrocław, 2010, s. 259 – 260.
[4] Baza leków i środków ochrony zdrowia BLOZ, www.bloz.pl, 2011.
[5] I. Teul, A. Ignys-O’Byrne, S. Baran: Use of over-the-couter medications in prevention and treatment of upper respiratory tract infections. Journal of Physiology and Pharmacology, 2008, 59, 135-143.
[6] A. Frankowska: Polacy łykają miliardy w tabletkach, Money.pl, 2008.
[7] A. Ottani, S. Leone, M. Sandrini, A. Ferrari, A. Bertolini The analgesic activity of paracetamol is prevented by the blockade of cannabinoid CB1 receptors, European Journal of Pharmacology, 531, 2006, s. 280–281.
[8] Charakterystyka produktu leczniczego Apap Direct Max 1000mg, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, www.urpl.gov.pl, Warszawa 2011.
[9] K. Orzechowska-Juzwenko: Farmakologia kliniczna. Znaczenie w praktyce medycznej, Górnicki Wyd. Medyczne, Wrocław, 2006, s. 44 – 45.
[10] J.G. Bessems, N.P. Vermeulen: Paracetamol (acetaminophen)-induced toxicity: molecular and biochemical mechanisms, analogues and protective approaches, Critical Reviews in Toxicology, 31, 2001,s. 55–138.
[11] Al. Allen: The diagnosis of acetaminophen toxicosis in a cat, Canadian Veterinary Journal 44 (6), 2003, s. 509–510.
[12] R.D. Jones, R.E. Baynes, C.T. Nimitz: Nonsteroidal anti-inflammatory drug toxicosis in dogs and cats: 240 cases (1989-1990), Journal of the American Veterinary Medical Association, 201 (3), 1992, s. 475-477.
[13] R. Jalan, R. Williams, J. Bernuau: Paracetamol: are therapeutic doses entirely safe?, The Lancet, Vol 368, December 23/30, 2006.
[14] M. Kiszka, G. Buszewicz: Paracetamol as a possible cause of fulminant liver failure, Problems of Forensic Sciences, vol. LV, 2003, 20–36.
[15] I. Maciejewska-Paszeka, K. Pawłowska-Góral, M. Kostrzewski, E. Kurzeja, M. Wardas, A. Rzepecka-Stojko: The influence of small doses of paracetamol on rabbit liver, Experimental and Toxicologic Pathology, 59 (2007), s. 139–141.
[16] L. J. Williams, J. A. Pasco, M. J. Henry, K. M. Sanders, G. C. Nicholson, M. A. Kotowicz, M. Berk: Paracetamol (acetaminophen) use, fracture and bone mineral density, Bone, 48, 2011, s. 1277–1281.
[17] K. Friese: Leki w ciąży i laktacji, MedPharm Polska, Wrocław, 2010, s. 83 – 84.
[18] S. Shaheen: Paracetamol and asthma: A causal link?, Reproductive Toxicology, 32, 2011, s. 150–153.
[19] G. Barr: Does paracetamol cause asthma in children? Time to remove the guesswork, The Lancet, vol. 372, September 20, 2008.
[20] J. Lawrence, E. Moore, L. Port, M. Danchin, T. Connell: Paracetamol as a risk factor for allergic disorders, The Lancet, vol. 373, January 10, 2009.
[21] U. Hassa, P. R. Jacobsena, J. Boberga, S. Christiansena, C. Nellemanna, D. Mřbjerg Kristensenb, H. Leffers: Developmental exposure to paracetamol causes anti-androgenic effects in male rat offspring, Reproductive Toxicology, 30, 2010 s. 227–232.
[22] S. R. Ahmad: Safety of recommended doses of paracetamol, The Lancet, vol. 369 February 10, 2007.
[23] A. Ni Mhaolain, B. Kelly, E. Breen, P. Casey: Paracetamol availability in pharmacy and non-pharmacy outlets in Dublin, Abstracts for Poster session III / European Psychiatry, 23, 2008, s. 304.
[24] Á. Mhaoláin, B. D. Kelly, E. G Breen, P. Casey: Legal limits for paracetamol sales, The Lancet, Vol. 369 April 21, 2007.
[25] O. Morgan: Laws limiting the size of paracetamol packs help to prevent overdose, Evidence-Based Healthcare & Public Health, 9, 2005, s. 197–199.
[26] J. L Turvill, A. K Burroughs, K. P Moore: Change in occurrence of paracetamol overdose in UK after introduction of blister packs, The Lancet, Vol. 355, June 10, 2000.






Komentarze obsługiwane przez CComment